El agua es más que una bebida.🚰
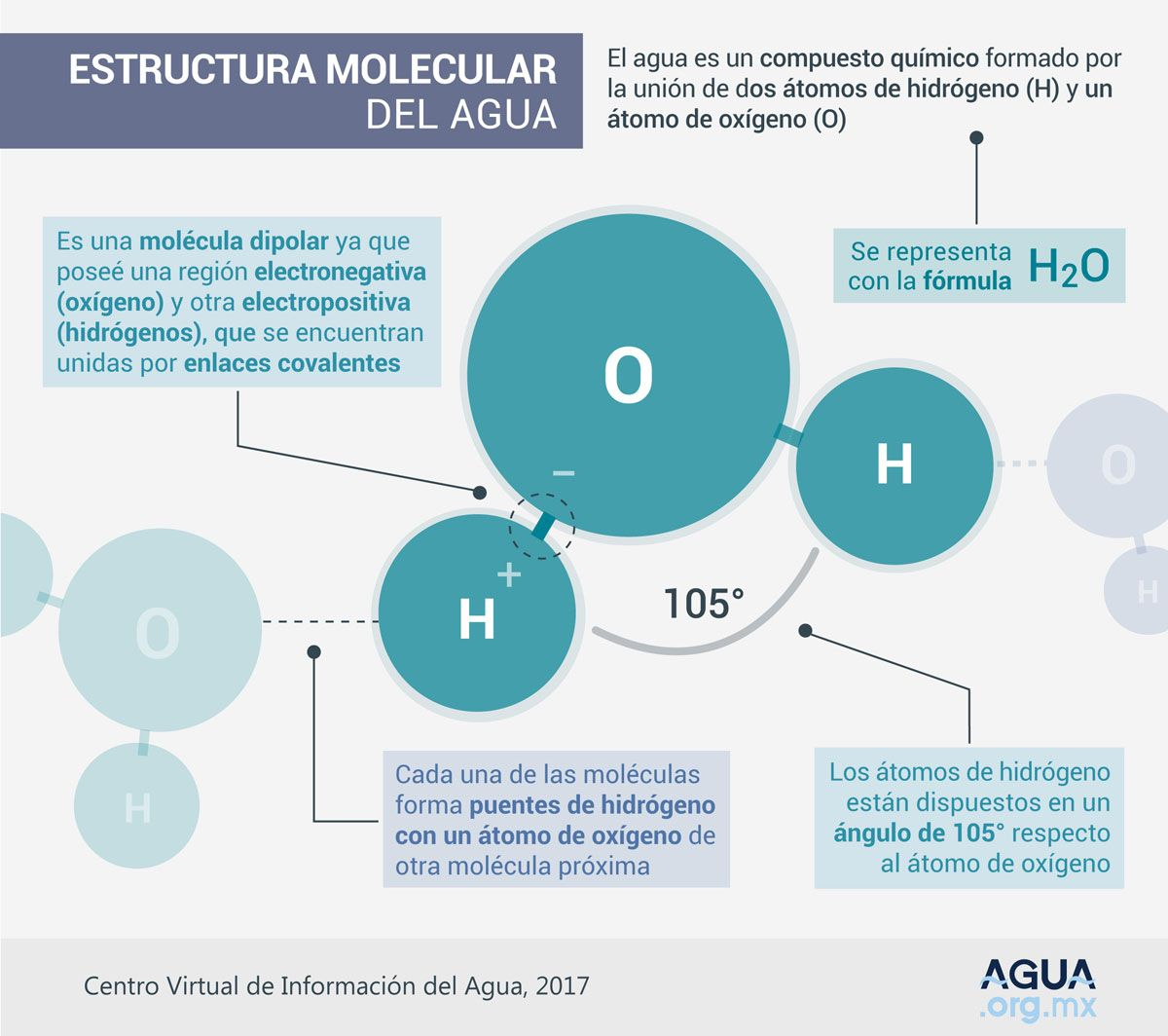
El agua es un compuesto que se forma a partir de la unión, mediante enlaces covalentes, de dos tomos de hidrógeno y uno de oxígeno; su fórmula molecular es H2O y se trata de una molécula muy estable.
En la estructura de la molécula los dos átomos de hidrógeno y el de oxígeno están dispuestos en un ángulo de 105°, lo cual le confiere características relevantes.
Es una molécula dipolar – en la que el átomo de oxígeno central comparte un par de electrones con cada uno de los dos átomos de hidrógeno – con un exceso de carga negativa junto al oxígeno, compensada por otra positiva repartida entre los dos átomos de hidrógeno.
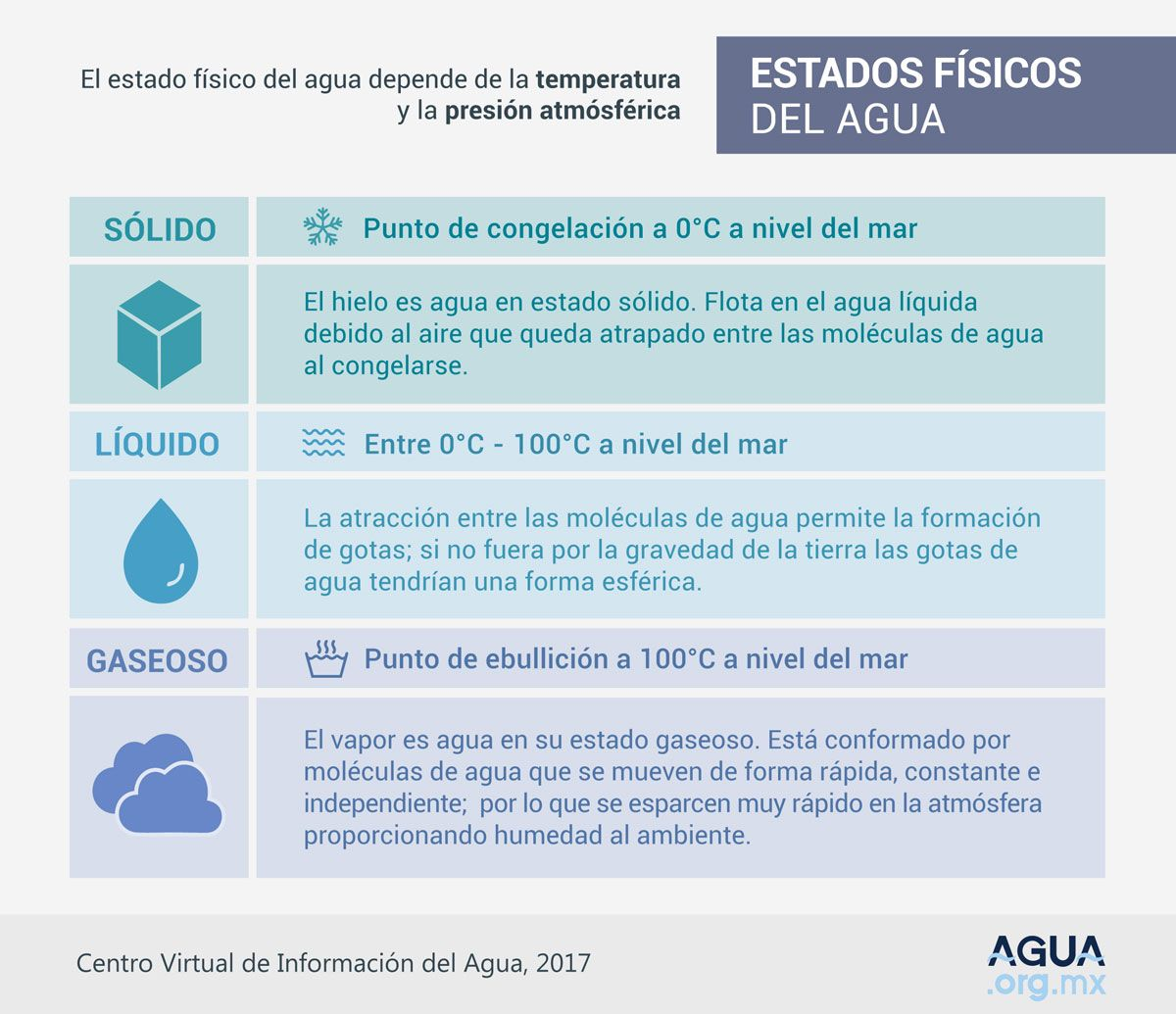
Se encuentra en el ambiente en cualquiera de los tres estados de la materia: sólido, líquido y gaseoso.
Propiedades químicas del agua.
- Elevada fuerza de cohesión entre sus moléculas: debido a los puentes de hidrógeno que se establecen las moléculas de agua permanecen unidas entre sí de forma más intensa que en otros compuestos similares.
- El agua es un líquido prácticamente incompresible: no es fácil reducir su volumen mediante presión, pues las moléculas de agua están enlazadas entre sí manteniendo unas distancias intermoleculares más o menos fijas. Por ello muchos organismos usan agua para fabricar sus esqueletos hidrostáticos, como los anélidos y celentéreos.
- Elevada tensión superficial: su superficie opone gran resistencia a romperse, lo que permite que muchos organismos puedan “andar” sobre el agua y vivan asociados a esa película superficial.
- Capilaridad: ascenso de la columna de agua a través de tubos de diámetro capilar, fenómeno que depende de la capacidad de adhesión de las moléculas de agua a las paredes de los conductos capilares y de la cohesión de las moléculas de agua entre si. Las plantas utilizan esta propiedad para la ascensión de la sabia bruta por el xilema.
- Elevado calor específico: Hace falta mucha energía para elevar su temperatura. esto convierte al agua en un buen aislante térmico.
- Elevado calor de vaporización: debido a que para pasar al estado sólido parte de la energía suministrada se emplea en romper los enlaces de puentes de hidrógeno.
- Mayor densidad en estado liquido que en estado sólido: el hielo flota en el agua.
- Elevada constante dieléctrica. Al ser un dipolo el agua se convierte en el gran disolvente universal: compuestos iónicos y polares se disuelven fácilmente en agua.
- Bajo grado de ionización: sólo una de cada 551.000.000 moléculas de agua se encuentra disociada en forma iónica. La concentración de iones hidroxilo (OH-1) y de iones de hidrógeno (protones) H+ es la misma 10-7 molar. El agua es desde el punto de vista del pH, neutra.
Fuentes:
-. (-). ¿QUÉ ES EL AGUA?. octubre 06, 2019, de Fondo para la Comunicación y la Educación Ambiental, A.C. Sitio web: https://agua.org.mx/que-es/
-. (1985). El Agua. Venezuela: Sociedad Venezolana de Ingeniería Hidráulica.
Escribe tu comentario